Аллергические заболевания характеризуются чрезвычайным многообразием клинических форм. В зависимости от возраста пациента и особенностей течения самой болезни аллергия может выражаться в виде кожных или респираторных проявлений различной степени тяжести. Во всех случаях пациенты с аллергическими заболеваниями нуждаются в эффективной терапии, вопросам подбора которой был посвящен сателлитный симпозиум, проведенный при поддержке компании «ЭГИС» во время XII Международного конгресса «Современные проблемы иммунологии, аллергологии и иммунофармакологии» (11–13 марта 2013 г., Москва).
Согласно современной классификации, в зависимости от этиологии и патогенеза различают такие формы ринита, как инфекционный (острый и хронический), аллергический (интермиттирующий и круглогодичный), профессиональный, вазомоторный, неаллергический (медикаментозный, гормональный, рефлекторный, идиопатический), гипер- и атрофический. Профессор Светлана Вячеславовна МОРОЗОВА (д.м.н., кафедра болезней уха, горла и носа лечебного факультета ГБОУ ВПО «Первый Московский государственный медицинский университет им. И.М. Сеченова» Минздрава России) подчеркнула, что каждый из подтипов требует тщательного и специфического лечения, вне зависимости от тяжести течения заболевания. Дело в том, что назальная обструкция в результате нарушений слизистой оболочки полости носа создает условия для кислородного голодания. Это приводит к развитию гипоксии центральной нервной системы и внутренних органов, повышению кровяного, внутричерепного и внутриглазного давления. Кроме того, среднетяжелые и тяжелые формы ринита негативно влияют на дневную активность, нарушается сон, а следовательно, снижается качество жизни больных. Затруднения носового дыхания у детей первого года жизни приводят к раздражительности и беспокойству, нарушениям сна и отказу от груди. Кроме того, в силу некоторых анатомических особенностей у детей ринит часто осложняется острым средним отитом. Наиболее распространенной формой ринита является острый инфекционный ринит. Так, в период эпидемии респираторных вирусных инфекций ежегодно заболевают до 6–8 человек из тысячи. Проявлениями ринита сопровождаются острые респираторные инфекции как вирусной (ОРВИ), так и бактериальной этиологии.
Лечение неосложненных форм ринита у взрослых, как правило, не вызывает затруднений. Классическая схема терапии этого заболевания включает промывание полости носа теплым физиологическим раствором, горячие ножные ванны и короткий курс сосудосуживающих препаратов. По мнению С.В. Морозовой, альтернативой деконгестантам может стать применение Супрастина. Хорошо известный и врачам, и пациентам как блокатор Н1-гистаминовых рецепторов, Супрастин также является конкурентным антагонистом мускариновых рецепторов, оказывающих влияние на стимуляцию секреции желез и вазодилатацию. Прием Супрастина уменьшает выраженность чихания благодаря способности препарата проникать сквозь гематоэнцефалический барьер и влиять на рецепторные образования в центре чихания в продолговатом мозге. Супрастин обладает способностью снижать гиперреактивность терморегуляторного центра головного мозга, что позволяет уменьшить дозу жаропонижающих препаратов. Существуют данные о том, что применение Супрастина одновременно с парацетамолом позволяет снизить дозу последнего в 4 раза 1 . Назначение Супрастина при остром инфекционном рините целесообразно еще и потому, что препарат способствует обратному развитию симптомов и уменьшает продолжительность заболевания. По данным собственного исследования С.В. Морозовой, назначение Супрастина в острой фазе ринита позволяет существенно купировать симптомы и сразу перевести течение заболевания в третью фазу. При назначении препарата во второй фазе заболевания резко сокращается выраженность выделений из носа, заложенности носа и чихания 2 . Немаловажно также, что Супрастин может применяться и у пациентов с острым инфекционным ринитом, которым противопоказаны деконгестанты. С инфекционным ринитом тесно связан аллергический ринит (АР) – интермиттирующее или персистирующее воспаление слизистой оболочки носа и его пазух, вызываемое причинно-значимым аллергеном. Доказано, что 10–12% случаев АР начинается с ОРВИ. Объясняется это, с одной стороны, способностью некоторых респираторных вирусов вызывать выработку иммуноглобулинов (Ig) класса E и потенцировать аллергический ответ, а с другой стороны, тем, что развивающееся на фоне ОРВИ повреждение слизистой оболочки носа само по себе способно усиливать симптомы АР. Для подтверждения аллергической природы ринита необходимо провести лабораторное исследование (эозинофилия крови и носового секрета). Обязательным также является определение общего уровня IgE и аллерген-специфических антител в сыворотке (радиоаллергосорбентный и хемилюминесцентный тесты) и взятие кожных проб (прик-тесты, скарификационные и внутрикожные пробы).
1 Стремоухов А.А., Мищенко Е.Б. Лечение ринита при острых респираторных вирусных инфекциях антигистаминными препаратами I поколения // www.lvrach.ru/2003/02/4530108.
2 Морозова С.В. Лечение ринита при острых респираторных вирусных инфекциях антигистаминными препаратами I поколения // www.lvrach.ru/2003/01/4530027.
Лечение АР базируется на элиминационной терапии (специфической иммунотерапии, диетотерапии и др.), а также фармакотерапии, включающей, в зависимости от течения заболевания, разные группы препаратов (рис. 1). Чаще всего пациентам с АР назначаются топические глюкокортикостероиды, антигистаминные препараты и деконгестанты. Эффективность препаратов разных групп в отношении симптомов АР неодинакова (табл. 1). Ключевую роль в развитии проявлений аллергии играет гистамин – медиатор, запускающий реакцию клеточного иммунного ответа, воздействующий на рецепторы респираторной системы и стимулирующий воспаление. Он также усиливает секреторные процессы, идущие в слизистой оболочке носа и дыхательных путей, что приводит к возникновению аллергического ринита. Именно поэтому антигистаминные средства, воздействующие на большое количество проявлений АР, оказываются практически незаменимыми в терапии А Р. В клинической практике до сих пор успешно используются антигистаминные препараты I и II поколения, однако на сегодняшний день на рынке представлены современные антигистаминные средства III поколения (например, Супрастинекс). В отличие от препаратов I поколения они почти не оказывают седативного и холинолитического действия, не проникают через гематоэнцефалический барьер, не снижают умственной и физической активности и имеют большую продолжительность действия. Действующее вещество Супрастинекса – левоцетиризин – является первым и пока единственным примером выделения активного изомера как самостоятельного противоаллергического лекарственного средства. Препараты на его основе зарегистрированы более чем в 80 странах мира. Управление по контролю качества пищевых продуктов и лекарственных препаратов США (Food and Drug Administration, FDA), разрешая выход препарата левоцетиризина на американский рынок, основывалось на результатах 8 рандомизированных плацебоконтролируемых исследований, в которых приняли участие в общей сложности более 2000 пациентов. В многочисленных исследованиях левоцетиризин продемонстрировал лучшую эффективность в отношении симптомов аллергии по сравнению с цетиризином, дезлоратадином, лоратадином или фексофенадином. Имеются также данные европейских исследований, доказавших, что Супрастинекс полностью биоэквивалентен оригинальному препарату левоцетиризина по всем основным фармакокинетическим характеристикам.
Рис. 1. Ступенчатая схема терапии аллергического ринита
| Системные стероиды | ||||
| Топические стероиды | ||||
| Кромогексал и недокромил натрия | ||||
| Короткие курсы топических деконгестантов Неседативные антигистаминные препараты внутрь Антигистаминные препараты местно Элиминация аллергена Специфическая терапия аллергенами | ||||
| Ступени терапии | I | II | III | IV |
| Тяжесть течения | Легкое интермиттирующее | Легкое персистирующее | Средней тяжести | Тяжелое |
Таблица 1. Эффективность фармакотерапии в устранении симптомов аллергического ринита
| Препараты | Зуд/чихание | Выделение | Заложенность | Нарушение обоняния |
| Антигистамины | +++ | ++ | + | — |
| Топические глюкокортикостероиды | +++ | +++ | ++ | + |
| Сосудосуживающие средства | — | — | +++ | — |
Левоцетиризин оказывает не только антигистаминное, но и противовоспалительное действие. Благодаря этому Супрастинекс эффективно устраняет как симптомы ранней фазы аллергического ответа (зуд, гиперемию, отек), так и проявления поздней стадии аллергии, аллергического воспаления. Для препарата характерно быстрое действие – у 50% больных эффект развивается уже через 12 минут после приема, а у 95% – в течение 1 часа. При этом прием Супрастинекса не сопровождается такими неприятными побочными эффектами, как сонливость, ощущение сухости во рту или тахикардия.
Супрастинекс выпускается в двух формах, таблетированной и жидкой, и может применяться как во взрослой, так и в детской практике. Препарат отличается чрезвычайно удобным режимом дозирования (как правило, он применяется 1 раз в сутки), что особенно важно для сохранения приверженности терапии длительными курсами. В исследованиях демонстрируется также очень хорошая переносимость препарата – он не вызывает побочных эффектов у 95% пациентов. Препарат может использоваться как для монотерапии, так и в составе комплексного лечения ринита различной этиологии. Таким образом, антигистаминные препараты имеют важные преимущества в терапии АР. Их применение позволяет купировать такие симптомы, как отек, затруднение носового дыхания, гиперсекреция и ринорея, зуд и жжение в полости носа. Кроме того, антигистаминные препараты находят свое применение в комплексной терапии острого инфекционного ринита, подавляя симптомы и уменьшая продолжительность заболевания.
Атопический дерматит – многофакторное заболевание, возникающее у лиц с наследственной предрасположенностью, обусловленное сложными иммунными механизмами развития аллергического воспаления в органе-мишени – коже. Врач аллерголог-иммунолог Ольга Гурьевна ЕЛИСЮТИНА (к.м.н., ФГБУ «ГНЦ Институт иммунологии» ФМБА России) отметила, что единой точки зрения на первопричины заболевания не существует. По одним данным, причиной заболевания является дисбаланс иммунного ответа, в результате которого происходит гиперпродукция IgE и развитие сенсибилизации организма к различным аллергенам. По другим – атопический дерматит развивается в результате генетически детерминированного нарушения функции эпидермального барьера, а также структурных и функциональных изменений кожи. В любом случае нарушение защитной функции эпидермиса чревато повышенной проницаемостью кожного покрова и риском проникновения в организм аллергенов и инфекционных агентов. Среди вероятных причин грибковой и микробной колонизации кожи больных атопическим дерматитом выделяют дефект врожденного иммунного ответа, нарушение местного и общего иммунитета, изменение pH на поверхности кожи, изменение защитных свойств кожи, обусловленное нарушениями секреции сальных и потовых желез, и др. Практически у каждого человека кожа, особенно верхней части тела, колонизирована грибами рода Malassezia (90%). На коже здорового человека в 22,8% случаев также определяются грибы Candida spp. Однако грибы рода Malassezia и Candida способны выступать не только в роли комменсалов, но и паразитов, вызывая специфический иммунный ответ у больных атопическим дерматитом. Так, Malassezia spp. при определенных условиях под влиянием эндогенных и экзогенных факторов могут переходить из дрожжевой в патогенную мицелиальную форму. Сходным диморфизмом обладают и грибы рода Candida. Антигены Malassezia spp. и Candida spp. провоцируют развитие IgE-опосредованной реакции. Кроме того, у пациентов наблюдается перекрестная реактивная активность между дрожжевыми грибами. Актуальность этой проблемы чрезвычайно высока: по разным данным, антитела к перечисленным грибам выделяются у 40–100% пациентов с атопическим дерматитом.
Качественный состав грибковой флоры, определяемой на коже больных атопическим дерматитом, зависит от локализации проявлений заболевания. Malassezia spp. обладают уникальным свойством – облигатной липофильностью, поэтому, как правило, поражают сальные железы. Если дерматит развился на волосистой части головы, высока вероятность того, что у пациента обнаружится патологический рост Malassezia spp. Если же заболевание развилось в областях кожных складок, оно чаще сопровождается кандидозом.
Наличие грибковой инфекции при атопическом дерматите изменяет клиническую картину заболевания, утяжеляет его течение и очень часто приводит к диагностическим ошибкам и назначению неадекватной терапии. Заподозрить наличие инфекции Candida spp. у пациентов, страдающих атопическим дерматитом, можно по следующим признакам:
- тяжелое непрерывное течение заболевания, сопровождающееся мокнутием и интенсивным зудом, несмотря на адекватно назначенную противовоспалительную терапию;
- отсутствие улучшения в летнее время года;
- связь обострений с употреблением в пищу продуктов, содержащих дрожжеподобные грибы и углеводы;
- поражение крупных складок кожи;
- вскрытие экссудативных элементов с образованием эрозий, содержащих белесоватый налет.
На присоединение Malassezia spp. указывают другие симптомы:
- локализация поражения в области богатых сальными железами участков кожи лица, воротниковой зоны, а также волосистой части головы и шеи;
- желтовато-красные шелушащиеся пятна и папулы различного размера, начинающиеся от устьев волосяных фолликулов, сливающиеся между собой;
- участки гипопигментации, чередующиеся с гиперпигментацией.
Диагностика грибковых инфекций проводится при помощи лампы Вуда. Используются также микроскопическое, бактериологическое и культуральное исследования, ПЦР-диагностика, определение специфических IgE-антител к антигенам Candida spp. и Malassezia spp., а также кожные скарификационные, внутрикожные и аппликационные тесты. Лечение грибковой инфекции у пациентов с атопическим дерматитом включает диетотерапию, применение системных противогрибковых препаратов, пробиотиков, местных антимикотических и антисептических средств, препаратов цинка и средств по уходу за кожей. Существуют многочисленные исследования, демонстрирующие положительный эффект противогрибковой терапии. Так, в исследовании O. Bäck и соавт. продолжительная противогрибковая терапия позволила уменьшить тяжесть течения атопического дерматита, а также добиться снижения уровня IgE к антигенам грибов рода Candida и Malassezia 3 . В работе M. Tajima и соавт. противогрибковая терапия в 70% случаев улучшила состояние кожи пациентов и в 90% случаев позволила элиминировать Malassezia 4 .
3 Bäck O., Bartosik J. Systemic ketoconazole for yeast allergic patients with atopic dermatitis // J. Eur. Acad. Dermatol. Venereol. 2001. Vol. 15. № 1. P. 34–38.
4 Tajima M. Malassezia species in patients with seborrheic dermatitis and atopic dermatitis // Nihon. Ishinkin. Gakkai. Zasshi. 2005. Vol. 46. № 3. P. 163–167.
Однако противогрибковая терапия не включена в стандартную схему лечения атопического дерматита, так как применение системных антимикотиков сопряжено с рядом сложностей. Во-первых, элиминация дрожжевой микрофлоры увеличивает риск заражения патогенными микроорганизмами. Во-вторых, длительное системное применение антимикотиков может сопровождаться нежелательными реакциями. В-третьих, грибковая микрофлора при длительном использовании противогрибковых препаратов может сформировать к ним резистентность. Именно поэтому антимикотическая терапия с целью уменьшения контаминации кожи грибковой микрофлорой должна назначаться только при клинических проявлениях атопического дерматита, осложненных клинически значимой и лабораторно подтвержденной грибковой инфекцией.
Одним из наиболее перспективных противогрибковых средств является современный препарат Залаин на основе сертаконазола – антимикотика последнего поколения. Он обладает уникальным тройным механизмом действия. Повреждая мембрану гриба и нарушая механизмы его роста, сертаконазол способствует уменьшению численности популяций грибов. Кроме того, Залаин ингибирует трансформацию Candida albicans, препятствуя превращению дрожжевой формы в мицелиальную.
Фунгицидная активность Залаина в отношении Candida albicans превосходит таковую клотримазола, кетоконазола, миконазола и бифоназола 5 , при этом препарат эффективен также в отношении возбудителей сопутствующей бактериальной инфекции. Залаин хорошо переносится, на фоне его приема не развивается фотосенсибилизация, кроме того, для препарата не характерна системная абсорбция. Он может с успехом применяться у пациентов с атопическим дерматитом, страдающих от сопутствующего дерматоза.
5 Palacín C., Sacristán A., Ortiz J.A. In vitro comparative study of the fungistatic and fungicidal activity of sertaconazole and other antifungals against Candida albicans // Arzneimittelforschung. 1992. Vol. 42. № 5A. P. 711–714.
В заключение докладчик подчеркнула, что противогрибковая терапия при атопическом дерматите, осложненном клинически значимой и лабораторно подтвержденной грибковой инфекцией, является рациональной. В таких случаях назначение антимикотиков позволяет значительно повысить эффективность лечения.
Вопросам диагностики и особенностям течения крапивницы у детей посвятил свой доклад профессор Александр Николаевич ПАМПУРА (д.м.н., заведующий отделением аллергологии и клинической иммунологии ФГБУ «Московский НИИ педиатрии и детской хирургии» Минздрава России). Поскольку существующая классификация крапивницы создавалась с учетом особенностей взрослых пациентов, в педиатрической практике она должна применяться с определенными ограничениями. То же можно сказать и о современных подходах к диагностике и лечению крапивницы. Так, механически перенесены из взрослой практики тесты с физическими воздействиями. Не удовлетворяют требованиям педиатра и критерии рецидивирующей крапивницы. У детей отличаются само течение заболевания и его прогноз, который в наибольшей степени зависит от этиологических факторов развития заболевания (рис. 2). Диагноз острой крапивницы в педиатрии может быть поставлен только после исключения целого ряда патологий: контактной крапивницы, физической или особой (например, холинергической) крапивницы, сывороточной болезни, ангионевротического отека без уртикарий, аутовоспалительного синдрома и анафилаксии. Далеко не всегда наличие волдыря (первичного элемента кожной сыпи, представляющего собой локальный отек сосочкового слоя дермы) является указанием на наличие крапивницы. В качестве примера А.Н. Пампура привел клинический случай Димы Б. (7 лет), который поступил в стационар с кожными высыпаниями, представленными в виде уртикарий и папулезных элементов, тяжелейшим зудом и нарушениями сна. Назначенная пациенту антигистаминная терапия оказалась неэффективной. После консультации дерматолога ребенку был поставлен диагноз «герпетиформный дерматит Дюринга». Диагноз был поставлен с учетом истинного полиморфизма высыпаний (наличие эритем, пузырьков, уртикароподобных элементов, эрозий и корок), наличия субэпидермальных пузырей и отложений IgA, повышения уровня эозинофилов в крови и, как уже упоминалось, отсутствия эффекта от антигистаминной терапии. Пациенту была рекомендована пожизненная безглютеновая диета, предполагающая также исключение продуктов и лекарств, содержащих йод, кроме того, ребенку был назначен препарат дапсон в дозировке 1 мг/кг/сут. Состояние пациента улучшилось практически сразу после коррекции рациона. Основную сложность в данном клиническом случае представляла именно диагностика. Вообще, дифференциальная диагностика крапивницы нередко сопряжена с целым рядом затруднений, особенно если пациентом является ребенок младшего возраста. Для облегчения этой задачи можно воспользоваться, например, специальной таблицей (табл. 2). Если у ребенка наблюдаются кожные высыпания, не исчезающие после приема антигистаминных препаратов, скорее всего, речь идет не о крапивнице, а о каком-либо другом заболевании с кожной симптоматикой.
Рис. 2. Результаты катамнестического наблюдения пациентов с хронической крапивницей через 1 год (n = 126) и 3 года (n = 84)
Таблица 2. Дифференциальный диагноз уртикарий и уртикароподобных элементов
| Диагноз | Характеристика высыпаний |
| Уртикарии | Только типичные высыпания Эритематозные отечные высыпания Транзиторные ( 24–36 ч) Симметричные Остаются следы (нарушения пигментации и рубцы) Присутствуют другие элементы (папулы, везикулы, пурпура и т.д.) Обычно не ассоциированы с ангионевротическим отеком |
Заболеваемость острой крапивницей у детей характеризуется сезонностью: в зимний период она растет в связи с увеличением количества случаев инфицирования вирусами гриппа, парагриппа, респираторно-синцитиальным вирусом, аденовирусом и риновирусами, а в летнее время развитие крапивницы связано с повышением распространенности коксакивируса, коронавируса и аденовирусов. В лечении острой крапивницы используются антигистаминные препараты (в частности, Супрастин), глюкокортикостероиды (при наличии показаний) и диета с исключением продуктов, содержащих распространенные аллергены (яйца, рыба, морепродукты, орехи), а также продуктов с высокой концентрацией гистаминлибераторов.
Для диагностики хронической крапивницы у детей докладчик рекомендовал придерживаться алгоритма (рис. 3). Вне зависимости от предполагаемых причин заболевания, диагностика должна проводиться по возможности быстро, поскольку зуд, сопровождающий крапивницу, существенно снижает качество жизни ребенка. Для лечения хронической крапивницы наиболее рациональным является применение антигистаминных препаратов II поколения или комбинаций средств I и II поколения и сочетаний антигистаминных средств II поколения с антилейкотриеновыми препаратами. Эффективность лечения оценивается на 5-е сутки. Одним из самых действенных средств для лечения крапивницы считается антигистаминный препарат левоцетиризин, который в 4 раза превосходит по эффективности цетиризин (рис. 4). Помимо оригинального препарата на основе левоцетиризина для лечения крапивницы с успехом может применяться Супрастинекс, дженерик с доказанной биоэквивалентностью.
Рис. 3. Алгоритм диагностики хронической крапивницы у детей
Рис. 4. Сравнительная эффективность левоцетиризина и цетиризина
Согласно эпидемиологическим данным, которые привела профессор Елена Сергеевна ФЕДЕНКО (д.м.н., заведующая отделением аллергологии и иммунопатологии кожи ФГБУ «ГНЦ Институт иммунологии» ФМБА России), на сегодняшний день атопическим дерматитом страдают 15–30% детей и 2–10% взрослых. Всего в мире с этим заболеванием живут около 40–50 млн человек. Атопический дерматит нередко проявляется одновременно с пищевой аллергией, ее признаки наблюдаются у 40% детей со среднетяжелым и тяжелым атопическим дерматитом. На сегодняшний день общепризнанной является теория атопического марша, согласно которой эти два заболевания первыми развиваются у детей с генетической предрасположенностью к аллергии. В более позднем возрасте у таких детей также могут развиться сенная лихорадка или бронхиальная астма. В свете вышесказанного становится ясно, какими проблемами чревата широко распространенная среди детей аллергия к белкам коровьего молока – ей страдают 0,5–1,5% младенцев, находящихся на грудном вскармливании, и 2–7% «искусственников». Среди детей первого года жизни, страдающих атопическим дерматитом, данная форма пищевой аллергии встречается в 85– 90% случаев. У детей старше трех лет распространенность атопического дерматита и пищевой аллергии снижается, однако на смену ей приходят респираторные проявления аллергии (рис. 5)6. Если же у одного пациента наблюдается сочетание атопического дерматита, АР и бронхиальной астмы, это свидетельствует о дермато-респираторном синдроме или, в случае со взрослыми пациентами, о тяжелом атопическом синдроме. Основной причиной развития атопии является генетическая предрасположенность. Всего на сегодняшний день открыто 37 генов, ассоциированных с атопическими заболеваниями. Последние исследования указывают на то, что нарушение функции эпидермального барьера связано с мутациями в гене, ответственном за синтез белка филаггрина. В результате этих мутаций экспрессия белка снижается, что облегчает проникновение аллергенов в кожу и способствует развитию сенсибилизации, а следовательно, появлению не только атопического дерматита, но и респираторной атопии. Нарушения работы иммунной системы у пациентов с атопией приводят к тому, что у одного и того же больного могут одновременно присутствовать очаги острого и хронического воспаления.
При атопическом дерматите наблюдается повышение содержания гистамина в коже, однако чувствительность к аппликациям или внутрикожному введению этого вещества снижена, что может свидетельствовать либо о нарушении плотности и аффинности Н1-рецепторов, либо о повышенном распаде гистамина в коже. Назначение антигистаминных препаратов таким пациентам обычно оказывается малоэффективным. Впрочем, это явление чаще наблюдается у взрослых больных, у которых в патогенезе атопического дерматита превалирует хроническое воспаление. В педиатрической практике патогенез атопического дерматита тесно связан с T2-ответом, и применение антигистаминных препаратов, как правило, приводит к положительным результатам, особенно если речь идет об антигистаминных средствах последнего поколения, обладающих не только противоаллергическим, но и противовоспалительным эффектом. На протяжении долгих лет пациентам с атопическим дерматитом назначались антигистаминные препараты I поколения, которые, оказывая седативный эффект, корректируют нарушенный из-за зуда сон. Однако использование более современных средств также способно повлиять на течение заболевания, например, предотвратить развитие или купировать респираторные проявления. Антигистаминные препараты могут применяться и как часть базисного лечения, и для купирования обострений, и в качестве премедикации перед проведением рентгеноконтрастных исследований и оперативных вмешательств. Кроме того, они широко используются у пациентов, получающих аллергенспецифическую иммунотерапию.
До недавнего времени в аллергологии применялся препарат цетиризин, показывавший хорошие результаты. Однако появление левоцетиризина вывело антигистаминную терапию на новый уровень. В левоцетиризине (Супрастинекс) отсутствует конкуренция за рецептор между неактивным правовращающим изомером и активным левовращающим, а длительность связывания цетиризина и левоцетиризна с рецепторами отличается приблизительно в 1,5 раза (95 и 142 минуты соответственно). В ходе исследования эффективности левоцетиризина у детей 9–14 лет, страдающих атопическим дерматитом, было показано, что двухнедельный курс левоцетиризина уменьшает выраженность зуда, расчесов и мокнутия. После проведенной терапии было зафиксировано изменение числа эозинофилов, тогда как уровень нейтрофилов не изменился. Снизился процент CD4+ T-клеток, экспрессирующих интерлейкин (ИЛ) 5, и CD4+, экспрессирующих ИЛ-13, уровень же CD+, экспрессирующих ИЛ-10, напротив, повысился до нормальных значений7. «Это означает, что левоцетиризин позволяет контролировать аллергическое воспаление, следовательно, его применение у пациентов с атопическими заболеваниями обоснованно», – подчеркнула в завершение доклада профессор Е.С. Феденко.
Инсектная аллергия может развиваться при ужалениях или укусах взрослых особей представителей как минимум 13 отрядов насекомых. Однако, как отметила профессор Татьяна Германовна ФЕДОСКОВА (д.м.н., ФГБУ «ГНЦ Институт иммунологии» ФМБА РФ), укусы и ужаления насекомых представляют собой лишь один из возможных путей сенсибилизации к их антигенам. Полный список способов, которыми антигены насекомых проникают в человеческий организм, выглядит следующим образом:
- парентеральный – с ядом при ужалениях, а также с секретом слюнных желез при укусах кровососущих и кусающих насекомых;
- аэрогенный – при вдыхании частиц тел и продуктов жизнедеятельности насекомых;
- контактный – при соприкосновении кожи и слизистых с продуктами жизнедеятельности насекомых;
- алиментарный – через желудочно-кишечный тракт (при употреблении насекомых в пищу, а также при поедании продуктов, зараженных экскрементами насекомых, или приеме лекарственных средств, являющихся продуктом жизнедеятельности насекомых).
Инсектная аллергия может возникнуть и в отсутствие непосредственного контакта с насекомыми, например, при купании в водоемах со стоячей водой или вследствие употребления в пищу морепродуктов (ракообразных или моллюсков). На контакт с насекомыми и продуктами их жизнедеятельности организм человека может отреагировать патологическими реакциями нескольких типов:
- аллергические реакции гиперчувствительности немедленного (IgE-опосредованного), иммунокомплексного и замедленного типов;
- псевдоаллергические реакции;
- токсические реакции.
Истинная аллергия к жалящим насекомым встречается, по разным данным, у 0,4–8% популяции, к нежалящим – у 1,7–17,5%. Факторами риска развития истинной аллергии являются отягощенный аллергологический анамнез (сенсибилизация к аллергенам клещей домашней пыли, плесневых грибов, эпидермиса животных), место жительства, предполагающее повышенный риск контакта с насекомыми, род деятельности (пчеловоды, лесничие, егеря, работники инсектариев и др.). Вопросы предупреждения инсектной аллергии представляют собой серьезную проблему прежде всего потому, что контакт с насекомыми невозможно прогнозировать.
Клинические проявления инсектной аллергии чрезвычайно разнообразны. К местным формам аллергии на насекомых относятся папулезные, везикулезные или буллезные элементы, острая эритематозная реакция, отек с зоной гиперемии, воспаление с исходом в рубцевание, а также респираторные проявления – заложенность носа, ринорея и др. Среди системных проявлений инсектной аллергии выделяют такие опасные состояния, как ангионевротический отек и анафилактический шок, а также острую крапивницу и удушье. С риском для жизни может быть сопряжена даже местная аллергическая реакция на контакт с насекомым, если отек развился в полости рта или горла. Для инсектной аллергии характерна сенсибилизация: при повторных укусах кровососущих насекомых аллергические реакции возникают также в местах более ранних укусов. Относится это и к системным проявлениям – все пациенты, перенесшие анафилактический шок в результате контакта с насекомым, оказываются в группе риска повторной тяжелой реакции на ужаление или укус.
Несмотря на огромное разнообразие клинических проявлений инсектной аллергии, а также факторов, способных спровоцировать ее развитие, врачебный подход к пациентам с гиперергической реакцией на ужаления и укусы насекомых должен быть единым. Таких пациентов необходимо направлять на консультацию к аллергологу для проведения аллергологического обследования и назначения соответствующей терапии. Основными принципами терапии инсектной аллергии являются элиминация аллергенов, проведение профилактических мероприятий в группах риска, обучение пациентов и их родственников, а также фармакотерапия. Для устранения зуда у пациентов с инсектной аллергией профессор Т.Г. Федоскова рекомендовала назначать Супрастин, а для борьбы с проявлениями ранней фазы аллергического ответа и предотвращения развития поздней стадии – антигистамин последнего поколения – Супрастинекс. Немаловажно, что оба эти препарата могут применяться как у взрослых пациентов, так и в педиатрической практике. Как правило, Супрастин назначается в первые 1–2 недели обострения аллергического заболевания (при необходимости препарат вводится в инъекционной форме), а Супрастинекс – в период ремиссии, для ее поддержания. В целом инсектная аллергия успешно поддается терапии, и проведение адекватного лечения позволит не доводить случаи инсектной аллергии до тяжелых состояний.
Лечение аллергических заболеваний подразумевает назначение препаратов разных фармакологических групп. Особое внимание докладчики уделили роли антигистаминных средств в терапии аллергического ринита, аллергического дерматита, крапивницы, инсектной аллергии. Целесообразность применения антигистаминных препаратов при различных аллергических заболеваниях определяется широким спектром эффектов гистамина. Этот медиатор может вызывать патофизиологические реакции со стороны разных органов и систем (дыхательных путей, кожи, желудочно-кишечного тракта, сердечно-сосудистой системы и др.). Таким образом, препараты, блокирующие гистаминовые рецепторы, эффективно предотвращают и купируют симптомы аллергии. Свойства антигистаминных препаратов различаются в зависимости от того, к какому поколению принадлежит средство. Именно поэтому в одних случаях показан проверенный временем препарат первого поколения Супрастин, а в других — современное средство Супрастинекс на основе левоцетиризина. Оба эти препарата обладают доказанной эффективностью и безопасностью и по праву занимают свое место в схемах лечения аллергических заболеваний.
– Аллергия – это актуальная междисциплинарная проблема. Многие специалисты по роду своей деятельности постоянно взаимодействуют с пациентами, страдающими аллергическими заболеваниями. Так, например, к оториноларингологам за помощью обращаются пациенты с аллергическим ринитом – заболеванием, чрезвычайно широко распространенным на территории нашей страны. Выделяют две формы аллергического ринита – круглогодичный и сезонный, проблема последнего чрезвычайно остро встает сейчас, в период цветения растений. Именно поэтому и врачи разных специальностей, и сами пациенты, и члены их семей должны знать о существовании антигистаминных препаратов, способных снизить выраженность аллергических реакций, в том числе и при аллергическом рините.
– В рамках симпозиума мы обсудили важные проблемы, связанные с разными аллергическими заболеваниями, в том числе и поллиноза. Как правило, в России отмечается три пика подъема содержания пыльцы в воздухе. Они приходятся на вторую половину апреля – май (цветение деревьев), июнь-июль (цветение луговых трав), август-сентябрь (цветение сорных трав, полыни). Для клинической картины поллиноза характерны аллергический конъюнктивит, аллергический ринит и бронхиальная астма. Несмотря на достаточно яркую симптоматику сезонных аллергических заболеваний, их диагностика и лечение представляют значительную проблему. Диагностика поллиноза основывается на тщательном сборе и анализе анамнеза заболевания и полноценном аллергологическом обследовании, включающем кожные аллерготесты (при отсутствии противопоказаний) или определение специфических IgE. Затруднения, как правило, вызывает интерпретация полученных данных и, соответственно, назначение адекватной терапии. Именно поэтому выступающие эксперты сделали акцент на алгоритмах диагностики и схемах терапии аллергических заболеваний.
источник
Аллергический ринит (АР) не относится к тяжелым и угрожающим жизни заболеваниям, но его медико-социальное значение определяется:
высокой распространенностью среди детей, подростков и взрослых: АР страдают от 15 до 40% лиц всех возрастов [1];
существенным снижением качества жизни больных;
ограничением, связанным с обучением и профессиональной деятельностью.
Кроме того, АР связан с такими заболеваниями, как бронхиальная астма, острый и хронический риносинусит, аллергический конъюнктивит, экссудативный средний отит [1].
Этиология и патогенез аллергического ринита
Ингаляционные аллергены, как сезонные (пыльца растений, споры плесневых грибов), так и круглогодичные (клещи домашней пыли, аллергены домашних животных), являются главными факторами, запускающими аллергическую реакцию, лежащую в основе развития симптомов АР. Паттерн доминирующих аллергенов зависит от географического региона и степени урбанизации. Например, для средней полосы РФ наиболее значимы сезонные аллергены, такие как пыльца деревьев и луговых трав, для южных регионов – пыльца сорных трав. Как известно, распространенность АР среди жителей больших городов существенно выше, чем среди жителей сельской местности. Это обусловлено воздействием воздушных поллютантов – выхлопных газов, озона, оксида азота и диоксида серы, табачного дыма. Атмосферные поллютанты способны увеличивать аллергенные свойства пыльцы, нарушать барьерные функции слизистых оболочек дыхательных путей человека и усиливать симптомы АР за счет стимуляции механизмов назальной реактивности. Некоторые из них, в частности дизельный выхлопной газ, могут стимулировать синтез иммуноглобулина (Ig) E и аллергическое воспаление.
Механизм развития АР представляет собой классический пример немедленной IgE-обусловленной аллергической реакции (рис. 1) [2].
Главными участниками аллергического воспаления, развивающегося в слизистой оболочке носа в результате взаимодействия аллергена со специфическими IgE-антителами, являются эозинофилы, лимфоциты, тучные, эпителиальные и эндотелиальные клетки. Аллергенспецифические IgE-антитела, образующиеся в избытке при контакте с аллергеном у предрасположенных к атопии лиц, фиксируются на высокоаффинных рецепторах к ним (FcεRI), расположенных на тучных клетках. Это приводит к сенсибилизации слизистой оболочки носа. Следующий контакт с аллергеном и связывание последнего с фиксированными на тучных клетках IgE-антителами способствуют активации тучных клеток и секреции медиаторов аллергического воспаления: гистамина, триптазы, кининов, цистеиниловых лейкотриенов (С4, D4, E4), простагландина D2. Медиаторы воздействуют на эндотелиальные клетки сосудов и нейрорецепторы слизистой оболочки носа, вследствие чего развиваются клинические симптомы АР (рис. 1). На фоне воспаления слизистой оболочки носа назальные симптомы могут персистировать в течение нескольких часов после контакта с аллергеном, а слизистая оболочка становится более реактивной к провоцирующим аллергенам (эффект прайминга), равно как и к другим аллергенам и неаллергическим триггерам (например, резкому запаху или холодному воздуху) [3]. Развивается специфическая и неспецифическая гиперреактивность назальной слизистой оболочки. На рис. 2 представлены IgE-опосредованное высвобождение медиаторов воспаления при аллергическом рините и бронхиальной астме, развитие ранней и поздней фаз аллергической реакции и место основных классов лекарственных средств (антигистаминных, антилейкотриеновых препаратов и топических глюкокортикостероидов (ГКС)).
Классификация аллергического ринита
Выделяют следующие формы АР:
сезонный – возникает при сенсибилизации к пыльцевым и грибковым аллергенам: пыльце деревьев, злаковых и сорных трав, спорам грибов Cladosporium, Penicillium, Alternaria, Aspergillus и др.;
круглогодичный – развивается у пациентов с сенсибилизацией к аллергенам клещей домашней пыли, библиотечной пыли, эпидермальным аллергенам животных и птиц, инсектным аллергенам, аллергенам плесневых грибов, пищевых продуктов и лекарственных препаратов при их постоянном приеме, профессиональным аллергенам.
Современная классификация АР, основанная на длительности и тяжести симптомов, была предложена международными сообществами (EAACI/WAO (European Academy of Allergy and Clinical Immunology/World Allergy Organization – Европейская академия аллергологов и клинических иммунологов/Всемирная организация аллергологов), программа ARIA (Allergic Rhinitis and its Impact on Asthma – аллергический ринит и его влияние на астму) 2008, 2010) (рис. 3) [1]. Подразделение АР на интермиттирующий и персистирующий успешно применяется в нашей стране на протяжении многих лет.
Диагностика аллергического ринита
Перечислим основные составляющие диагностики АР и сопутствующего ему аллергического конъюнктивита:
анамнез: семейный анамнез, время появления симптомов, их сезонная вариабельность, профессиональный маршрут;
клиническая картина: описание симптомов (ринорея, чихание, зуд в носу, нарушение носового дыхания и нередко обоняния);
специфическое аллергологическое обследование: кожные пробы с аллергенами, определение аллергенспецифических IgE-антител, назальные и конъюнктивальные провокационные тесты с аллергенами.
Диагноз АР часто основывается на клинических симптомах и эмпирической эффективности антигистаминных препаратов и интраназальных ГКС (ИнГКС), однако верифицированный диагноз АР можно поставить только после специфического аллергологического обследования, которое служит и дифференциально-диагностическим приемом в отношении неаллергического ринита. Следует помнить, что существует много разных видов неаллергических/неинфекционных ринитов: гормональный, медикаментозный, неаллергический эозинофильный ринит, ринит, индуцированный пищей, ирритантный, атрофический, эмоциональный и идиопатический/вазомоторный.
Как показали результаты исследований последних лет, 47–62,5% пациентов с симптомами ринита, ранее диагностированного как неаллергический или идиопатический, имеют локальную (в назальной слизистой оболочке) гиперпродукцию аллергенспецифических IgE и положительный назальный провокационный тест с такими аллергенами, как клещ домашней пыли, Alternaria alternata, пыльца злаковых трав и оливы [4–8]. Эта форма АР называется локальной.
Пациенты с локальным АР характеризуются клиническим фенотипом круглогодичного или сезонного АР (обычно среднетяжелого/тяжелого течения), Th2-профилем воспаления в слизистой оболочке носа. При этом у них выявляются отрицательные кожные пробы с аллергенами и отсутствие аллергенспецифических IgE в сыворотке крови. Диагностику локального АР проводят с помощью назальных провокационных тестов с аллергенами [4–8].
Ступенчатая терапия аллергического ринита
Основные принципы терапии аллергического ринита заключаются в следующем:
предотвращение или сокращение контакта с аллергенами и триггерами;
использование лекарственных средств;
проведение специфической иммунотерапии аллергенами;
Ступенчатая терапия АР, предложенная в документе ARIA 2008, получила дальнейшее развитие в недавно опубликованной позиционной статье EAACI, посвященной ринитам у детей [9]. В статье представлен алгоритм терапии АР у детей, который вполне применим и у взрослых (рис. 4).
Новая концепция лечения АР, основанная на контроле симптомов, была предложена недавно в документе PRACTALL [10]. В таблице 1 представлены критерии контроля ринита, основанные на оценке симптомов, качества жизни пациентов и данных объективного обследования. В настоящее время нет единого определения контроля ринита, равно как и инструмента для его оценки. Однако несколько вопросников активно изучаются для этой цели (CARAT, RCAT, VAS и др.) [11–14]. Большинство разработанных вопросников основаны на определении дневных и ночных симптомов, степени их влияния на работоспособность, способность к обучению и сон, а также требуемой терапии и необходимости в ее увеличении. Временной период оценки контроля симптомов АР колеблется от одной до четырех недель, предшествующих консультации [11, 12]. Критерии (симптомы и качество жизни), представленные в табл. 1, предлагается оценивать за последние четыре недели. Любое отклонение от этих критериев указывает на утрату контроля, и может быть рассмотрена терапия step-up, равно как и при увеличении потребности в препаратах «спасения» (деконгестантах, оральных ГКС). Безусловно полезны объективные тесты для определения назального дыхания: измерение назальной пиковой скорости вдоха, риноманометрия и очень простой для применения в обычной клинической практике тест «дыхание с закрытым ртом» (табл. 1). Следует помнить, что сопутствующие АР заболевания способны влиять на контроль симптомов. От 10 до 40% больных АР страдают бронхиальной астмой [1], многие имеют синдром обструктивного апноэ/гипопноэ сна [15].
Для достижения контроля предлагается терапия, состоящая из четырех ступеней. Каждая из них включает различные варианты фармакологической терапии в зависимости от выраженности симптомов АР (рис. 5) [10]. Принцип ступенчатого подхода к лечению АР, равно как и бронхиальной астмы, заключается в увеличении объема терапии/переходе на ступень вверх (step-up) при отсутствии контроля симптомов АР и снижении объема терапии/переходе на ступень вниз (step-down) в случае достижения и поддержания контроля симптомов АР.
Фармакологические препараты для контроля симптомов аллергического ринита
Оральные антигистаминные препараты первого поколения не рекомендуются для лечения АР в силу их хорошо известных нежелательных побочных эффектов (выраженное седативное действие, тахифилаксия, сухость слизистых оболочек, задержка мочи, тахикардия, повышение аппетита и др.). Антигистаминные препараты второго поколения (АГП II) лишены недостатков своих предшественников и имеют доказанную эффективность при АР: при легких симптомах в виде монотерапии, при среднетяжелых/тяжелых в комбинации с ИнГКС (рис. 5). Они, как правило, являются препаратами первого выбора у пациентов с легкими симптомами сезонного и круглогодичного АР как интермиттирующего, так и персистирующего течения.
Назначение оральных АГП II обусловлено их влиянием не только на назальные симптомы, но и на конъюнктивальные проявления, которые отмечаются у 71,4% взрослых больных АР, проживающих в Европе [16].
Большое проспективное мультицентровое исследование по установлению главных критериев, определяющих выбор АГП II для терапии АР у 1080 пациентов, было недавно проведено во Франции. Как оказалось, основной причиной выбора какого-либо АГП II была его ожидаемая эффективность, а сопутствующий конъюнктивит был связан с более быстрым ответом на лечение АГП II [17].
Интраназальные антигистаминные препараты проявляют быстрый эффект в отношении назальных симптомов, но имеют ограниченное влияние на глазные симптомы.
Существование системной связи между АР и бронхиальной астмой обусловливает рациональность применения единой системной терапии этих заболеваний. Среди фармакологических препаратов наиболее полно удовлетворяют этому требованию антагонисты лейкотриеновых рецепторов.
Как известно, в основе бронхиальной астмы и АР лежит аллергическое воспаление, в формировании которого помимо гистамина и цитокинов участвуют цистеиниловые лейкотриены (цис-LT) (LТС4, LТD4, LТЕ4 и LТВ4). Большинство фармакологических эффектов цис-LТ, имеющих отношение к патофизиологии АР и бронхиальной астмы, осуществляются через активацию специфических цис-LТ1-рецепторов, расположенных на тучных клетках, моноцитах и макрофагах, эозинофилах, базофилах, нейтрофилах, Т- и В-лимфоцитах, гладкомышечных клетках, бронхиальных фибробластах и эндотелиальных клетках. Поэтому фармакологические препараты – антагонисты цис-LТ1-рецепторов (монтелукаст, зафирлукаст и пранлукаст) давно одобрены во многих странах мира и хорошо зарекомендовали себя в лечении бронхиальной астмы и АР у взрослых и детей. Монтелукаст – препарат, наиболее часто применяемый в Европе, в том числе в нашей стране, и Северной Америке. Антагонисты LТ-рецепторов принимают перорально. Это означает, что они оказывают системный эффект на аллергическое воспаление, тем самым обеспечивая целесообразность назначения при сочетании АР и бронхиальной астмы. В ряде исследований доказана эффективность подобной терапии, особенно у пациентов с АР и бронхиальной астмой.
В пункте 16 международных рекомендаций ARIA 2010 [18], составленных европейскими экспертами с позиции GRADE [19] – качества доказательств и силы рекомендаций, предлагается применение оральных антагонистов LT-рецепторов у взрослых и детей с сезонным АР и у детей дошкольного возраста с персистирующим АР. Кроме того, комбинация монтелукаста с ИнГКС рекомендуется при тяжелых симптомах АР (рис. 5). Таким образом, терапия антагонистами LТ-рецепторов (монтелукаст) у больных АР и сопутствующей бронхиальной астмой приводит к лучшему контролю обоих заболеваний.
ИнГКС – самые эффективные препараты в терапии АР. Они используются для лечения АР с 1973 г. Именно тогда появился первый препарат этой группы – беклометазона дипропионат.
В настоящее время на отечественном фармацевтическом рынке доступно много молекул ИнГКС: беклометазона дипропионат, будесонид, флутиказона пропионат, мометазона фуроат и флутиказона фуроат (табл. 2). Высокая эффективность ИнГКС при АР обусловлена их выраженным противовоспалительным действием и эффективным влиянием на все этапы патогенеза болезни. Эти препараты уменьшают количество тучных клеток и секрецию ими медиаторов аллергии, сокращают количество эозинофилов, Т-лимфоцитов, клеток Лангерганса в слизистой оболочке носа, ингибируют синтез простагландинов и лейкотриенов, подавляют экспрессию молекул адгезии. Указанные эффекты приводят к редукции тканевого отека и нормализации носового дыхания, уменьшению секреции слизистых желез, чувствительности рецепторов слизистой оболочки носа и прекращению ринореи и чихания, подавлению специфической и неспецифической назальной гиперреактивности. Современные формы ИнГКС хорошо переносятся пациентами и могут использоваться в качестве базисной терапии среднетяжелых/тяжелых форм АР без риска угнетения мукоцилиарного транспорта и развития атрофии слизистой оболочки. ИнГКС иногда вызывают местные побочные эффекты: сухость в носу, образование корочек, непродолжительные носовые кровотечения. Но эти осложнения не опасны и чаще связаны с неправильной техникой использования препарата, когда струя из пульверизатора направляется в сторону перегородки носа, а не на латеральную стенку полости носа.
Кроме того, необходимо соблюдать правило противоположной руки: инсуффляция в правую ноздрю осуществляется левой рукой, а в левую – правой.
Современные назальные ГКС практически лишены системного эффекта, что обусловлено их низкой системной биодоступностью, связанной с минимальной абсорбцией из желудочно-кишечного тракта и практически полной трансформацией в неактивные метаболиты при первом пассаже через печень. Например, у мометазона фуроата системная биодоступность всего 0,1%. Это означает, что современные ИнГКС могут длительно (в течение нескольких лет) использоваться в качестве базисной терапии персистирующего АР при очень незначительном риске развития системных побочных эффектов: угнетения гипоталамо-гипофизарно-надпочечниковой системы, замедлении роста у детей.
В рандомизированном двойном слепом плацебоконтролируемом исследовании с участием пациентов в возрасте от трех до девяти лет с круглогодичным АР применение мометазона фуроата (Назонекс®) в сравнении с плацебо в течение 12 месяцев не влияло на рост детей (рис. 6) [20]. В то же время применение флутиказона фуроата – назального спрея в дозе 110 мкг/сут в течение 52 недель привело к небольшому (на 0,27 см в год по сравнению с плацебо (95%-ный доверительный интервал, 0,48–0,06 cм/год)), но статистически значимому снижению темпов роста у детей препубертатного возраста [21]. При этом следует подчеркнуть, что оба препарата – мометазона фуроат и флутиказона фуроат – высокоэффективные ИнГКС в отношении симптомов АР. Это было продемонстрировано в восьминедельном рандомизированном слепом прямом сравнительном исследовании у пациентов с персистирующим аллергическим риноконъюнктивитом (рис. 7) [22].
Как уже отмечалось, АР часто, особенно у пациентов с сезонными проявлениями, сопровождается симптомами конъюнктивита. Результаты клинических исследований и реальная практика свидетельствуют об эффективности ИнГКС в отношении симптомов не только ринита, но и конъюнктивита, обусловленной подавлением назоокулярного рефлекса [22, 23]. На рис. 8 представлены результаты метаанализа четырех исследований мометазона фуроата в отношении влияния на глазные симптомы у пациентов с сезонным АР [23]. Назонекс® достоверно уменьшал все глазные симптомы у больных сезонным АР (зуд/жжение, слезотечение и покраснение/гиперемия) (р ≤ 0,05). Эффективность Назонекса при окулярных симптомах АР связана с подавлением назально-окулярного рефлекса в результате выраженного противовоспалительного эффекта в слизистой оболочке носа.
Эффективность Назонекса изучали при синдроме обструктивного апноэ сна у пациентов с АР. 80 участников исследования в возрасте 30–50 лет со средним индексом массы тела 34 кг/м 2 в течение шести недель получали мометазона фуроат 200 мкг/сут, дезлоратадин 10 мг/сут, их комбинацию или плацебо [15]. Отмечалось достоверное уменьшение индекса «апноэ – гипопноэ» и улучшение эффективности сна у пациентов, получавших мометазона фуроат + плацебо и мометазона фуроат + антигистаминный препарат (р 0,05). У пациентов, принимавших мометазона фуроат, наблюдались значительное уменьшение сонливости (р
источник
Аллергический ринит и его классификация. Аллергены, вызывающие развитие и обострение аллергического ринита. Биохимические медиаторы, функциональные нарушения и клинические проявления при аллергическом рините. Клиническая картина аллергического ринита и симптоматика. Диагностика и лечение.
Жерносек В.Ф., Белорусская медицинская академия последипломного образования
Аллергический ринит – заболевание, возникающее после контакта с аллергеном и обусловленное IgE-опосредованным воспалением слизистой оболочки носа, с характерными симптомами (ринорея, назальная обструкция, зуд носа, чихание), обратимыми спонтанно или под влиянием лечения [11].
В развитии аллергического ринита имеет значение воздействие внешних и внутрижилищных аллергенов (табл. 1).
Под воздействием аллергенов в слизистой оболочке полости носа формируется хроническое аллергическое воспаление с вовлечением различных типов клеток: эозинофилов, Т-лимфоцитов, тучных и эпителиальных. Степень и продолжительность воспаления зависит от концентрации аллергенов в окружении больного. При постоянном воздействии аллергенов воспаление персистирует круглый год. При сезонном воздействии аллергенов воспаление имеет интермиттирующий характер, оно постепенно угасает при прекращении воздействия причинно-значимого аллергена. Такой характер воспаления имеет место при аллергии к пыльце деревьев и растений, а также при сенсибилизации к микрогрибам, обитающим преимущественно вне жилища. Концентрация спор этих микрогрибов повышается ранней весной и поздней осенью. В процессе аллергического воспаления формируется повышенная неспецифическая реактивность слизистой полости носа. Она представляет собой усиленную реакцию на обычные стимулы в виде чихания, отека и/или секреции слизистой. В качестве неспецифических раздражителей (триггеров) выступают поллютанты жилых помещений, среди которых главным является табачный дым, а также холодный и сырой воздух, резкие запахи (парфюмерия, средства бытовой химии), выхлопные газы автотранспорта и др.
В процессе аллергического воспаления клетки, участвующие в его развитии, выделяют большое количество медиаторов. Наиболее значимы гистамин и лейкотриены. Медиаторы аллергического воспаления вызывают определенные функциональные нарушения и клинические проявления при аллергическом рините (табл. 2).
Таблица 2 Биохимические медиаторы, функциональные нарушения и клинические проявления при аллергическом рините [5]
Полость носа, околоносовые пазухи и трахеобронхиальное дерево представляют собой единое целое. Это объясняет частое сосуществование бронхиальной астмы, аллергического ринита и полипозного риносинусита. Возможными причинами сочетания ринита и бронхиальной астмы является сходство строения мерцательного эпителия, участие в патогенезе аллергии и идентичность вызывающих болезнь аллергенов, наследование атопии. Другой возможный нервнорефлекторный механизм развития сочетанной патологии – ринобронхиальная гиперреактивность и ринобронхиальный рефлекс.
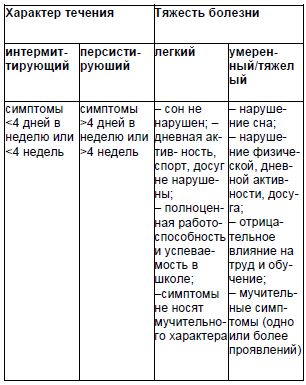
Классификация. Согласно последним официальным рекомендациям ВОЗ выделяют две формы аллергического ринита – интермиттирующий и персистирующий, а также две градации тяжести – легкий, умеренный/тяжелый(табл. 3).
В МКБ-10представлены следующие разновидности ринитов:J 30.1 Аллергический ринит, вызванный пыльцой растений; J 30.2 Другие сезонные аллергические риниты; J 30.3 Другие аллергические риниты; J 30.4 Аллергический ринит неуточненный.Примеры формулировки диагноза: Аллергический ринит, интермиттирующее течение, легкий, период ремиссии, сенсибилизация к пыльце райграса, тимофеевки. Аллергический персистирующий ринит, среднетяжелый, период обострения. Сенсибилизация к Dermatophagoidespteronissinus.
Клиническая картина аллергического ринита складывается из совокупности основных, дополнительных и общих неспецифических симптомов.
Основные клинические симптомы аллергического ринита: 1) ринорея ? водянистые выделения из носа; 2) чихание, нередко приступообразное, чаще в утренние часы, пароксизмы чихания могут возникать спонтанно; 3) зуд, реже чувство жжения в носу, иногда сопровождается зудом неба и глотки, может проявляться характерным симптомом ? «аллергиче-ским салютом» (постоянное почесывание кончика носа с помощью ладони движением снизу вверх), в результате чего у части детей появляется поперечная носовая складка, расчесы, царапины на носу; 4) заложенность носа, характерное дыхание ртом, сопение, храп, изменение голоса; снижение обоняния.
Дополнительные симптомы: 1) раздражение, отечность, гиперемия кожи над верхней губой и крыльев носа; 2) носовые кровотечения вследствие форсированного сморкания и ковыряния в носу; 3) боль в горле, покашливание из-за сопутствующего аллергического фарингита, ларингита; 4) боль и треск в ушах, особенно при глотании, нарушение слуха за счет аллергического туботита; 5) глазные симптомы в результате сопутствующего аллергического конъюнктивита в виде слезотечения, зуда, инъецированности склер и конъюнктивы, фотофобии, темных кругов под глазами, вызванных венозным застоем, причиной которого является отек слизистой оболочки носа и придаточных пазух.
Общие неспецифические симптомы: 1) слабость, недомогание, раздражительность; 2) головная боль, повышенная утомляемость, нарушение концентрации внимания; 3) потеря аппетита, иногда тошнота, чувство дискомфорта в области живота вследствие проглатывания большого количества слизи или при сопутствующих аллергических заболеваниях; 4) нарушение сна, подавленное настроение; 5) повышение температуры (крайне редко) [5, 9].
Диагностика. Диагноз аллергического ринита уточняется в ходе детального обследования пациента.
Основные диагностические исследования и их значение при аллергическом рините [1, 5, 9]:
1. Подтверждение эозинофильного характера воспаления слизистой носа:
-цитограмма мазка слизи из носа (выявление в лейкоцитарной формуле эозинофилов более 10% – вероятный признак аллергического воспаления);
-мазки-отпечатки слизистой оболочки полости носа (эозинофильная инфильтрация слизистой – вероятный признак аллергического воспаления).
2.Оценка активности аллергического воспаления: определение концентрации эозинофильного катионного белка (повышение его уровня – признак активности аллергического процесса).
3.Передняя риноскопия (бледность и отечность слизистой оболочки – характерный признак аллергического воспаления).
4. Функциональные исследования:
-назальная пикфлоуметрия (типично симметричное снижение проходимости носовых ходов);
-активная передняя риноманометрия (типично симметричное повышение сопротивления).
-эндоскопия придаточных пазух носа по показаниям;
-рентгенологическое исследование околоносовых пазух, или компьютерная томография, или магнитно-резонансная томография.
6. Мазок из носа на флору и чувствительность к антибиотикам при наличии синусита
7. Диагностика спектра сенсибилизации:
-кожные пробы с аллергенами;
-анализ уровня общего и специфических IgE;
-провокационные тесты с аллергенами по показаниям (осуществляются аллергологом).
Лечение. Лечение аллергического ринита должно быть направлено на достижение и поддержание контроля над симптомами заболевания, профилактику обострений заболевания, улучшение качества жизни больного, лечение сопутствующей патологии, которая усугубляет течение аллергического ринита, а также на предотвращение развития бронхиальной астмы.
Лечение аллергического ринита должно быть комплексным. Основные составляющие программы лечения и реабилитации [2,5]:
1.Устранение причинно-значимого аллергена и создание гипоаллергенного быта.
2.Гипоаллеpгенная диета по показаниям.
4.Базисная противовоспалительная терапия.
5.Иммунотерапия причинно-значимым аллергеном.
Организация гипоаллергенного быта.Контроль окружающей среды при аллергическом рините не только уменьшает вероятность обострения заболевания. Создание гипоаллергенного быта предохраняет пациента от расширения спектра сенсибилизации. Поэтому контроль окружающей среды важен не только при рините, обусловленном сенсибилизацией к бытовым, эпидермальным и грибковым аллергенам. Он актуален и должен рекомендоваться пациентам с сезонным аллергическим ринитом, обусловленным пыльцевой сенсибилизацией.
Питание больных.При круглогодичном аллергическом рините, обусловленном бытовой и эпидермальной сенсибилизацией, специальной диеты не требуется. Она назначается только при наличии сопутствующей пищевой аллергией. Определенные ограничения в диете требуются пациентам с аллергией к пыльце растений. Из питания исключаются пищевые продукты, перекрестно реагирующиеили имеющие антигенное родство с пыльцой причинно-значимых растений. Пищевые продукты с антигенным родством или способные вызывать перекрестные аллергические реакции могут поддерживать аллергическое воспаление в полости носа и служить причиной персистенции симптомов в осенне-зимний период года при поллинозах.
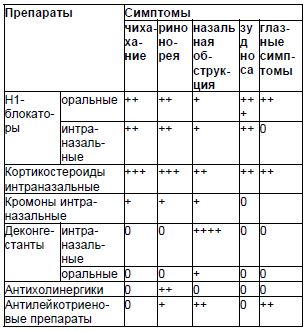
Медикаментозная терапия. В настоящее время в лечении аллергического ринита применяются пять групп лекар-ственных препаратов: интраназальные кортикостероиды, антилейкотриеновые препараты, кромоны, Н1-гистаминоблокаторы, деконгестанты, антихолинергики. Влияние различных групп медикаментов на симптомы аллергического ринита представлено в табл. 4.
Только интраназальные кортикостероиды способны эффективно купировать все симптомы аллергического ринита [1]. По результатам метаанализа доказано, что интраназальные кортикостероиды более эффективны в лечении аллергического ринита, чем антилейкотриеновые препараты, системные и интраназальные антигистаминные средства [19].
Проблемой больных аллергическим ринитом является наличие сопутствующих глазных симптомов, которые выявляются с частотой до 70% [21]. Интраназальные глюкокортикостероиды также способны купировать глазные симптомы. Механизмы действия интраназальных глюкокортикостероидов, обусловливающие их эффективность в отношении глазных симптомов, в настоящее время хорошо изучены. Ведущий из них – подавление назоокулярного рефлекса, дополнительный – улучшение лакримо-назального оттока.
Широкое применение интраназальных кортикостероидов объясняется не только их высокой эффективностью, но и безопасностью. Безопасность интраназальных кортикостероидов сегодня не вызывает сомнений, хотя системная биодоступность выше у старых препаратов интраназальных кортикостероидов. В рекомендуемых дозах интраназальные кортикостероиды не оказывают отрицательного влияния на состояние гипоталамо-гипофизарной системы [6, 15].
Требования, которые предъявляются к современные инраназальным кортикостероидам, четко сформулированы: высокая аффинность к рецепторам; высокая селективность; высокая тропность к тканям; длительное персистирование в тканях; низкая вероятность развития системных побочных эффектов; минимальная биодоступность; отсутствие активных метаболитов; высокая комплаентность и удобство дозирования [7].
Историческая хроника внедрения в клиническую практику различных интраназальных стероидов следующая: 1973 г. – беклометазона дипропионат, 1981 г. – будесонид, 1990 г. – флутиказона пропионат, 1996 г. – мометазона фуроат, 2007 г.– флутиказона фуроат. Таким образом, если раньше новые интраназальные стероиды вводились в клиническую практику с небольшим интервалом, то самый последний из них поступил на вооружение с самым длительным интервалом – 11 лет.
Флутиказона фуроат (Авамис) – новый синтетический трифторированный глюкокортикостероид с наиболее высокой аффинностью и селективностью к глюкокортикостероидному рецептору среди всех существующих препаратов этой группы. Молекула флутиказона фуроата характеризуется высокой аффинностью, быстрой ассоциацией и медленной диссоциацией по отношению к глюкортикостероидному рецептору. Это приводит к тому, что препарат сохраняется в тканях в значительно большем количестве при изначально одинаковой концентрации по сравнению с другими интраназальными стероидами. Этот феномен позволил уменьшить разовую лечебную дозу препарата. Уменьшение лечебной дозы препарата при сохранении терапевтического потенциала снижает вероятность развития системных нежелательных эффектов [2, 4, 7, 14].
Авамис выпускается в виде назального дозированного спрея по 27,5 мкг флутиказона фуроата в 1 дозе по 120 доз во флаконе. Устройство для доставки препарата является оригинальной инновационной разработкой и имеет ряд преимуществ перед другими средствами доставки лекарственных средств для лечения аллергического ринита. Нажимной клапан находится на боковой поверхности флакона. Боковая кнопка активации требует минимум усилий пациента и обеспечивает снижение вариации дозирования препарата. Отличительной особенностью флакона является наличие индикаторного окна, что позволяет контролировать содержание препарата. Наконечник короткий, что облегчает применение лекарственного средства и обеспечивает однородность его дозирования. К тому же препарат удобно вводить другому пользователю (ребенку). Дозирующее устройство обеспечивает образование мелкодисперсного аэрозоля. Кроме того, одна терапевтическая доза препарата содержится в вдвое меньшем объеме по сравнению с лекарственными формами других инраназальных стероидов, что исключает стекание препарата. Авамис после применения не дает послевкусия. Внешний вид назального спрея мало похож на продукцию медицинского назначения, что не создает для пациента психологического дискомфорта при необходимости применения в присутствии посторонних людей.
Препарат разрешен к применению у детей, начиная с двух лет жизни.
Показания: симтоматическое лечение сезонного и круглогодичного аллергического ринита у взрослых и детей старше двух лет.
Режим дозирования определяется возрастом пациента:
– взрослые и подростки (в возрасте от 12 лет и старше): начальная доза – 2 впрыскивания в каждую ноздрю 1 раз в сутки (общая суточная доза – 110 мкг); при достижении контроля симптомов – 1 впрыскивание в каждую ноздрю 1 раз в сутки (общая суточная доза – 55 мкг);
– дети в возрасте от 2 до 11 лет: начальная доза – 1 впрыскивание в каждую ноздрю 1 раз в сутки (общая суточная доза – 55 мкг); при отсутствии эффекта – до 2 впрыскиваний в каждую ноздрю 1 раз в сутки (общая суточная доза – 110 мкг). При достижении контроля симптомов – 1 впрыскивание в каждую ноздрю 1 раз в сутки (общая суточная доза – 55 мкг).
К настоящему времени хорошо изучены метаболизм и выведение флутиказона фуроата [17]. Системная биодоступность флутиказона фуроата ниже 0,5% [10, 12]. Препарат обладает самой высокой аффинностью к глюкокортикостероидным рецепторам из известных интраназальных стероидов [16]. Для флутиказона фуроата характерна значительно большая селективность в отношении глюкортикостероидных рецепторов по сравнению с другими известными интраназальными глюкортикостероидами [31].
Для флутиказона фуроата по сравнению с другими интраназальными кортикостероидами характерно быстрое начало действия. Доказано, что флутиказона фуроат начинает оказывать положительное влияние на назальные симптомы аллергического ринита через 8 ч от начала лечения [12].
Степень приверженности к лечению при лечении флутиказона фуроатом выше по сравнению с другими интраназальными стероидами [26].
В мультицентровом двойном слепом рандомизированном плацебо-контролируемом исследовании была убедительно доказана эффективность лечения Авамисом аллергического круглогодичного ринита у подростков старше 12 лет и взрослых в режиме приема 1 раз в день в суточной дозе 100 мкг [28]. M. Vasar et al. [34] в рандомизированном двойном слепом плацебоконтролируемом исследовании кроме значительного клинического улучшения у подростков и взрослых с круглогодичным аллергическими ринитом выявили выраженное улучшение функциональных характеристик носового дыхания – повышение показателей назальной пикфлоуметрии.
H.B. Kaizer et al. [18] доказали, что при хорошей переносимости интраназального спрея флутиказона фуроат является эффективным в лечении назальных симптомов сезонного аллергического ринита у пациентов старше 12 лет жизни. К аналогичному выводу пришли украинские исследователи [3].
Для флутиказона фуроата доказано достоверное положительное влияние на степень выраженности глазных симптомов, сопутствующих аллергическому риниту [20]. Так, продемонстрировано, что назальный спрей флутиказон фуроат с успехом подавляет назоокулярный рефлекс [13]. По сравнению с другими интраназальными кортикостероидами у флутиказона фуроата этот эффект при сезонном аллергическом рините был наивысшим [21]. В мультицентровом исследовании в различных географических регионах у взрослых и подростков с сезонным аллергическим ринитом доказано положительное влияние флутиказона фуроата на все назальные и глазные симптомы заболевания [23]. Интересно, что флутиказона фуроат является первым интраназальным глюкортикостероидом, который продемонстрировал одновременную высокую клиническую эффективность во всех исследованиях по отношению к носовым и глазным симптомам при сезонном аллергическом рините [32].
Проведены также многочисленные контролируемые исследования по применению флутиказона фуроата в педиатрической практике. Так, J.F. Maspero et al. [22] убедительно доказали эффективность и безопасность лечения Авамисом круглогодичного аллергического ринита у детей в возрасте от 2 до 11 лет включительно. Также доказана клиническая эффективность лечения сезонного аллергического ринита у детей 6–11 лет жизни [25] при высокой степени его безопасности как при сезонном, так и круглогодичном аллергическом рините у пациентов этой возрастной категории [27]. В систематизированном обзоре P.L. McCormack и L.J. Scott [24] показали не только высокую эффективность Авамиса в лечении аллергического ринита у детей с 2 лет жизни, подростков и взрослых, но также продемонстрировали высокую безопасность лечения флутиказона фуроатом. Частота побочных эффектов при лечении аллергического ринита у детей 2–11 лет жизни, подростков и взрослых не отличалась от плацебо. D.P. Patel et al. [29] показали, что лечение флутиказона фуроатом не вызывает угнетения гипоталамогипофизарной системы как у взрослых, так и подростков старше 12 лет жизни. Лечение флютиказона фуроатом аллергического круглогодичного ринита в течение 12 месяцев не вызывало системных побочных эффектов, свойственных системным глюкокортико-стероидам [31]. В последующем было также доказано, что флутиказона фуроат не оказывает отрицательного влияния на состояние гипоталамо-гипофизарной системы при лечении аллергического ринита у детей 2–11 лет жизни [33].
Лечение флутиказона фуроатом значительно улучшает качество жизни пациентов с аллергическим ринитом [16].
В лечении аллергического ринита используются и медикаменты других групп. Следует отметить, что значительно более слабым противоспалительным эффектом по сравнению с интраназальными глюкокортикостероидами обладают препараты кромоглициловой кислоты и недокромила.
Для лечения аллергического ринита применяются интраназальные и системные антигистаминные препараты второго поколения. В настоящее время для лечения аллергического ринита используются антилейкотриеновые препараты (монтелукаст, зафирлукаст). Для контроля симптомов аллергического ринита также применяются местные деконгестанты коротким, не более 5–7 дней, курсом.
Антихолинергические средства для лечения аллергического ринита в нашей стране не зарегистрированы.
В руководстве ARIA (2008) выделяют три ступени терапии. Первая соответст-вует легкому интермиттирующий риниту, вторая ? умеренному/тяжелому интермиттирующему и легкому персистирующему варианту, третья ? умеренному/тяжелому персистирующему. С учетом нового высокоэффективного интраназального кортикостероида Авамиса, зарегистрованного на нашем фармацевтическом рынке, эту схему можно представить следующим образом (табл. 5).
Иммунотерапия у пациентов с аллергическими ринитами причинно-значимыми аллергенами проводится по общепринятым принципам.Измененная иммунологическая реактивность, отек слизистой оболочки носа и околоносовых пазух, снижение местной иммунологической защиты в виде дефицита sIgA у пациентов с аллергическим ринитом приводят к тому, что на аллергическое воспаление часто наслаивается бактериальная инфекция. При появлении гнойного отделяемого из носа, явлений интоксикации больной должен быть осмотрен оториноларингологом для решения вопроса о применении специальных методов лечения. Основной принцип лечения синуситов – создание хороших условий для аэрации пазух и эвакуации секрета через естественные соустья. Несомненно, оптимальным является тот антибиотик, к которому чувствительна выделенная микрофлора. Однако бактериологическое исследование занимает определенный промежуток времени. Поэтому чаще всего используются антибиотики широкого спектра действия. Препаратами выбора могут быть ингибиторзащищенные аминопенициллины. Примером препарата является комбинация амоксициллина и клавулановой кислоты – Аугментин.
Таким образом, в лечении аллергического ринита как у детей, так и у взрослых, страдающих аллергическим ринитом, может быть использован новый интраназальный кортикостероид Авамис. Авамис с учетом высокой эффективности в отношении как носовых, так и глазных симптомов, необходимой низкой лечебной дозы, высокой безопасности может рассматриваться как препарат выбора в лечении аллергического ринита у детей, начиная с двух лет жизни, подростков и взрослых.
1. Аллергия у детей: от теории – к практике/ под ред. Л.С. Намазовой-Барановой. – М., 2010– 2011. – 668 с.
2.Астафьева Н.Г. // Рос. аллергол. журн. – 2010. – № 3. – С. 74–84.
3.Дитятковска Е.М., Родкiна I.А., Бiлецька С.В., Бендецька Ю.В. // Клiнiчна медицина. – 2010.–№ 1. – С. 1–4.
4. Емельянова А.В. // Рос. аллергол. журн.2010. – № 2. – С. 68–73.
5.Жерносек В.Ф., Дюбкова Т.П. Аллергические заболевания у детей: Рук. для врачей. ? Минск, 2003. ? 335 с.
6.Жерносек В.Ф. // Мед. новости. – 2010. – № 10. – С. 31–35.
7.Курбачева О.М., Павлова К.С. // Рос. аллергол. журн. – 2010. – № 6. – С. 64–68.
8.Международный консенсус в лечении аллергического ринита (Версия Европейской академии аллергологии и клинической иммунологии, 2000 // Рос. ринология. ? 2000. ? № 3. ? С. 5?27.
9. Научно-практическая программа «Аллергический ринит у детей» (Пособие для врачей). ? М., 2002. ? 79 с.
10.Allen A., Down G., Newland A. et al. // Clin. Therapeutics. – 2007. – Vol. 29, N 7. – P. 1415– 1421.
11.Allergic rhinitis and its impact on asthma (ARIA) 2008 Update (in collaboration with World Health Organization, GA2LEN and AllerGen) // Allergy.– 2008 (Suppl. 86). – P. 8–160.
12. Anolik R. // J. Asthma Allergy. – 2010. – N3. – P. 87–99.
13. Baroody F., Shenaq D., DeTineo M. et al. // J. Allergy Clin. Immunol. – 2009. – Vol. 123. – P. 1342–1348.
14. Charpin S. // Prescriber. – 2009. – 5 June.– P. 23–26.
15.Derendorf H., Meltzer E.O. // Allergy. – 2008. – Vol. 63. – P. 1292–1300.
16.Goyal N., Hochhaus G. // Drug Today. – 2008. – Vol. 44, N 4. – P. 251–260.
17.Hughes S.C., Shardlow P.C., Hollis F.J. et al. // Drug Metabolism Disposition. – 2008. – Vol. 36, N 11. – P. 2337–2344.
18.Kaiser H.B., Naclerio R.M., Given J. et al. // J. Allergy Clin. Immunol. – 2007. – Vol. 119. – P. 1430–1437.
19.Kariyawasam H.H., Scadding G.K. // J. Asthma Allergy. – 2010. – N 3. – P. 19–28.
20.Keith P.K., Scadding G.K. // Currents Med. Research Opinion. – 2010. – Vol. 26, N 1. – P.177.
21.Keith P.K., Scadding G.K. // Currents Med. Research Opinion. – 2009. – Vol. 25, N 8. – P 2021–2041.
22.Maspero J.F., Rosenblut A., Finn A. et al. // Otolaryngology – Head and Neck Surgery. – 2008. – Vol. 138. – P. 30–37.
23.Maspero J.F., Walter R.D., Wu W. et al. // Allergy Asthma Proc. – 2010. – Vol. 31. – P. 483–492.
24.McCormack P.L., Scott L.J. // Drugs. – 2007. – Vol. 67, N 13. – P. 1906–1915.
25.Meltzer E.O., Lee J., Tripathy I. et al. // Ped. Allergy Immunol. – 2009. – Vol. 20. – P. 279– 286.
26. Meltzer E.O., Stahman J.E., Leflein J. et al. // Clin. Therapeutics. – Vol. 2008. – Vol. 30, N 2. –P. 271–277.
27. Meltzer E.O., Tripathy I., Maspero J.F. et al. // Clin. Drug Invest. – 2009. – Vol. 29, N 2. – P. 79–86.
28. Nathan R.A., Berger W., Yang W. et al. // Ann. Allergy Asthma Immunol. – 2008. – Vol. 100. –P. 497–505.
29. Patel D., Ratner P., Clements D. et al. // Ann. Allergy Asthma Immunol. – 2008. – Vol. 100. –P. 490–496.
30.Rosenblut A., Bardin P.G., Muller B. et al. // Allergy. – 2007. – Vol. 62. – P. 1071–1077.
31.Salter M., Biggadike K., Matthews J.L. et al. // Am. J. Physiol. Lung Cell Mol. Physiol. – 2007. – Vol. 293. – P. L660–L667.
32.Scadding G., Keith P.K. // Expert. Opin. Pharmacother. – 2008. – Vol. 15, N 9. – P. 2707– 2715.
33.Tripathy I., Levy A., Ratner P. et al. // Ped. Allergy Immunology. – 2009. – Vol. 20. – P. 287–294.
34.Vasar M., Houl P.-A., Douglass A. et al. // Allergy Asthma Proc. – 2008. – Vol. 29. – P. 313–321.
источник